LA TABLA PERIÓDICA
La tabla periódica de los elementos es una disposición de los elementos químicos en forma de tabla, ordenados por su número atómico (número de protones), por su configuración de electrones y sus propiedades químicas. Este ordenamiento muestra tendencias periódicas, como elementos con comportamiento similar en la misma columna.
Grupo VII-A de la tabla periódica
Propiedades generales del grupo VllA
- Los elementos del grupo VIIA también llamados halógenos por ser todos formadores de sales. Tienen siete electrones en el último nivel y son todos no metales.
- Tienen las energías de ionización más elevadas y en consecuencia son los elementos más electronegativos.
- Reaccionan fácilmente con los metales formando sales, rara vez están libres en la naturaleza, todos son gaseosos a temperatura ambiente menos el bromo que es líquido en condiciones ambientales normales.
- Su característica química más fundamental es su capacidad oxidante porque arrebatan electrones de carga y moléculas negativas a otros elementos para formar aniones.
A ESTE GRUPO PERTENECEN LOS SIGUIENTES ELEMENTOS
F: Flúor.
Cl: Cloro.
Br: Bromo.
I: Yodo.
At: Astato.
En este caso se ven propiedades de física y química por ejemplo
- Propiedades Del Flúor:
físicas :
numero atómico : 9
primer potencial de ionización (Ev)
17.54
masa atómica (G/mol)
18.9984
Densidad (G/ml)
1.11
punto de ebullición (°c)
-188.2
punto de fusion (°c)
-219.6
Químicas :
Reacciona con violencia con los compuestos que contienen hidrógeno con el agua el amoniaco y otras sustancias orgánicas es un elemento muy toxico y reactivo
como esto se le puede sacar a cada uno de los elementos del grupo VIIA su estado químico y físico
Grandes Descubridores Del Grupo VllA
Flúor:
Descubridor: Henri Moissan.
Cloro:
Descubridor: Carl Wilhelm Scheele
Lugar de descubrimiento: Suecia.
Año de descubrimiento: 1774.
Origen del nombre: De la palabra griega "chloros", que significa "verde pálido", reflejando el color del gas.
Bromo:
Descubridor: Antoine J. Balard.
Descubridor: Antoine J. Balard.
Lugar de descubrimiento: Francia.
Año de descubrimiento: 1826.
Origen del nombre: De la palabra griega "brómos" que significa "fetidez", debido al fuerte y desagradable olor de este elemento, sobre todo de sus vapores.
Yodo:
Descubridor: Bernard Courtois.
Ástato:
Descubridor: Dale Corson, K. MacKenzie, Emilio Segrè.
GRUPO VIA TABLA PERIODICA
Elementos a los que pertenecen en el grupo VIA
-Oxigeno : O
- Azufre: S
- Selenio :Se
-Telurio :Te
-Polonio :Po
Propiedades Generales
- llamado también el grupo del oxigeno al ser el primer elemento del grupo
- su configuración externa es NS2 NP4
-ganan o ceden dos electrones al formar compuestos
-Los primeros elementos oxigeno, azufre, y selenio no son metales

Grupo del Oxigeno
El grupo VIA del sistema Periódico o grupo del oxígeno está formado por los elementos: oxígeno, azufre, selenio, telurio, polonio.
Por encontrarse en el extremo derecho de la Tabla Periódica es fundamentalmente no-metálico; aunque, el carácter metálico aumenta al descender en el grupo .
Como en todos los grupos, el primer elemento, el oxígeno, presenta un comportamiento anómalo, ya que al no tener orbitales d en la capa de valencia, sólo puede formar dos enlaces covalentes simples o uno doble, mientras que los restantes elementos pueden formar 2, 4 y 6 enlaces covalentes.

Q. Inorgánica. Grupo 5A de la tabla periódica
- Nitrógeno: N

- Fósforo : P

- Arsénico :As

- Antimonio :Sb
- Bismuto : Bi

Radios Atómicos :
El radio atómico está totalmente definido como la mitad de la distancia entre dos núcleos de dos átomos adyacentes. Diferentes propiedades físicas, densidad, punto de fusión, punto de ebullición, están relacionadas con el tamaño de los átomos. Identifica la distancia que existe entre el núcleo y el orbital más externo de un átomo. Por medio del radio atómico, es posible determinar el tamaño del átomo.
| H 0,25 | He | ||||||||||||||||
| Li 1,45 | Be 1,05 | B 0,85 | C 0,7 | N 0,65 | O 0,6 | F 0,5 | Ne | ||||||||||
| Na 1,8 | Mg 1,5 | Al 1,25 | Si 1,1 | P 1 | S 1 | Cl 1 | Ar | ||||||||||
| K 2,2 | Ca 1,8 | Sc 1,6 | Ti 1,4 | V 1,35 | Cr 1,4 | Mn 1,4 | Fe 1,4 | Co 1,35 | Ni 1,35 | Cu 1,35 | Zn 1,35 | Ga 1,3 | Ge 1,25 | As 1,15 | Se 1,15 | Br 1,15 | Kr |
| Rb 2,35 | Sr 2 | Y 1,8 | Zr 1,55 | Nb 1,45 | Mo 1,45 | Tc 1,35 | Ru 1,3 | Rh 1,35 | Pd 1,4 | Ag 1,6 | Cd 1,55 | In 1,55 | Sn 1,45 | Sb 1,45 | Te 1,4 | I 1,4 | Xe |
| Cs 2,6 | Ba 2,15 | * | Hf 1,55 | Ta 1,45 | W 1,35 | Re 1,35 | Os 1,3 | Ir 1,35 | Pt 1,35 | Au 1,35 | Hg 1,5 | Tl 1,9 | Pb 1,8 | Bi 1,6 | Po 1,9 | At | Rn |
| Fr | Ra 2,15 | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo |
| * | La 1,95 | Ce 1,85 | Pr 1,85 | Nd 1,85 | Pm 1,85 | Sm 1,85 | Eu 1,85 | Gd 1,8 | Tb 1,75 | Dy 1,75 | Ho 1,75 | Er 1,75 | Tm 1,75 | Yb 1,75 | Lu 1,75 | ||
| ** | Ac 1,95 | Th 1,8 | Pa 1,8 | U 1,75 | Np 1,75 | Pu 1,75 | Am 1,75 | Cm | Bk | Cf | Es | Fm | Md | No | Lr | ||
GRUPO 4 Tabla Periódica
El grupo 4 de la tabla está conformado por los siguientes elementos: carbono, silicio, germanio, estroncio y plomo.
los químicos empezaron a buscar una clasificación de los elementos no solo como objeto de facilitar el conocimiento de sus propiedades sino lo mas importante para facilitar las investigaciones y los avances en los conocimientos de la materia Nacimiento de la tabla periódica
La primera tabla periódica de los elementos nació más o menos de ese modo. El 17 de febrero de 1869, el hoy famoso químico ruso Dimitri Mendeléiev (1834-1907) canceló una visita que iba a hacer a una fábrica de quesos a la que estaba invitado y se puso a elaborar una tabla de los 63 elementos entonces conocidos, ordenándolos según su peso atómico y sus propiedades químicas. Mendeléiev, que llevaba unos diez años pensando en el asunto, confirmó entonces definitivamente su idea de que, si todos los elementos químicos se disponen en orden creciente de su peso atómico, se manifiesta una “repetición periódica” de propiedades
Metales :
son buenos conductores de electricidad y el calor
No metales:
malos conductores de calor y de electricidad
Metaloides:
presentan propiedades de metales y no metales
muchos de los grupos de la tabla periódica dependen de su comportamiento físico y químico
El átomo de carbono - Química orgánica - Educatina
El átomo de carbono :
La Química del carbono es la parte de la química que estudia sustancias compuestas casi en su totalidad de carbono e hidrógeno, y que a veces contienen pequeñas cantidades de otros elementos, como oxígeno, notrógeno, azufre o halógenos. Estos compuestos se denominan compuestos orgánicos porque se encuentran sobre todo en los seres vivos, y la parte de la Química que se ocupa de su estudio se denomina Química Orgánica.
El carbono tiene un número atómico de seis, lo que significa que teine seis protones en el núcleo y seis electrones en la corteza, que se distribuyen en dos electrones en la primera capa y cuatro en la segunda. Por tanto, el átomo de carbono puede formar cuatro enlaces covalentes para completar los ocho electrones de su capa más externa. Estos enlaces pueden ser de tres tipos: enlace simple, enlace doble y enlace triple.
Enlace simple
Es la manera más sencilla en la que el carbono comparte sus cuatro electrones. Los enlaces se colocan apuntando a los cuatro vértices de un tetraedro regular, estando el carbono en el baricentro de dicho tetraedro. Se dice que el carbono actúa de manera tetragonal.
El ejemplo más simple lo representa el metano, en el que un átomo de carbono comparte cada uno de sus cuatro electrones exteriores con un átomo de hidrógeno, de modo que tanto el carbono como cada uno de los cuatro hidrógenos completan su última capa electrónica.
El carbono tiene un número atómico de seis, lo que significa que teine seis protones en el núcleo y seis electrones en la corteza, que se distribuyen en dos electrones en la primera capa y cuatro en la segunda. Por tanto, el átomo de carbono puede formar cuatro enlaces covalentes para completar los ocho electrones de su capa más externa. Estos enlaces pueden ser de tres tipos: enlace simple, enlace doble y enlace triple.
| Enlace simple |
Es la manera más sencilla en la que el carbono comparte sus cuatro electrones. Los enlaces se colocan apuntando a los cuatro vértices de un tetraedro regular, estando el carbono en el baricentro de dicho tetraedro. Se dice que el carbono actúa de manera tetragonal.
El ejemplo más simple lo representa el metano, en el que un átomo de carbono comparte cada uno de sus cuatro electrones exteriores con un átomo de hidrógeno, de modo que tanto el carbono como cada uno de los cuatro hidrógenos completan su última capa electrónica. |
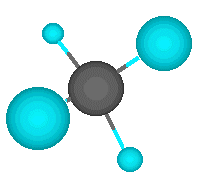
Pero el átomo de carbono puede formar enlaces con otros átomos de carbono, originando cadenas que puieden ser larguísimas. El ejemplo más simple de esto es un átomo de carbono que se une a tres hidrógenos y a otro carbono, que a su vez se une a otros tres hidrógenos. En este compuesto, de nombre etano, los dos carbonos actúan de forma tetragonal.
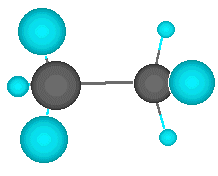
| Enlace doble |
El carbono no tiene por qué formar los cuatro enlaces con cuatro átomos distintos. Puede darse el caso de que dos de esos enlaces los forme con un mismo átomo. Hablamos entonces de un enlace doble. Los dos electrones que le quedan al carbono se enlazan con otrs dos átomos mediante enlaces simples. En este caso, el enlace doble y los dos simples apuntan a los vértices de un triángulo casi equilátero. Se dice que el carbono actúa de forma trigonal.
El ejemplo más simple es el etileno, en el que los dos carbonos comparten dos electrones entre sí y los otros dos que les quedan a cada uno los comparten con dos átomos de hidrgeno. La estructura es trigonal y plana. |
También puede el carbono formar el enlace doble con otros elementos, entre ellos el nitrógeno y el oxígeno, como veremos más adelante.
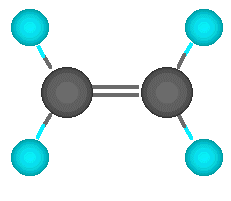
| Enlace triple |
Por último, puede el carbono formar tres enlaces con un mismo átomo, y el cuarto con un átomo distinto. Se habla entonces de un enlace triple. En este caso la molécula es lineal, y decimos que el carbono actúa de forma lineal.
El ejemplo más simple de esto es el acetileno, en el que dos carbonos se unen mediante un enlace triple y el electrón que les queda a cada uno lo comparten con un átomo de hidrógeno. Por supuesto, la molécula es lineal. También puede el carbono formar el enlace triple con otros elementos como el nitrógeno. |

Propiedades generales del carbono
El carbono es un elemento químico de numero 6 y símbolo (C) es solido a temperatura ambiente dependiendo de las condiciones de formación puede contraerse en la naturaleza en distintas formas alotrópicas, carbono amorfo y cristalino en forma de grafito o diamante el el pilar básico de la química orgánica se conoce cerca de 10 millones de compuestos de carbono y forma parte de todos los seres vivos conocidos

Característica especifica del carbono :
este elemento presenta dos características una en la cual se presenta dura como un diamante y otra en forma blanda
Un Ejemplo podría ser el dióxido de carbono que se forma con el oxigeno y los hidrocarburos con el hidrógeno
El carbono presente dos enlaces únicos uno el ionico y el otro el covalente
Enlace Covalente

Características del átomo de carbono
El carbono hace parte del grupo 4 de la tabla periódica
El carbono es un elemento notable por varias razones. Sus formas alotrópicas incluyen, una de las sustancias más blandas (el grafito) y una de las más duras (el diamante) y, desde el punto de vista económico, es de los materiales más baratos (carbón) y uno de los más caros (diamante). Más aún, presenta una gran afinidad para enlazarse químicamente con otros átomos pequeños, incluyendo otros átomos de carbono con los que puede formar largas cadenas, y su pequeño radio atómico le permite formar enlaces múltiples. Así, con el oxígeno forma el dióxido de carbono, vital para el crecimiento de las plantas (ver ciclo del carbono); con el hidrógeno forma numerosos compuestos denominados genéricamente hidrocarburos, esenciales para la industria y el transporte en la forma de combustibles fósiles; y combinado con oxígeno e hidrógeno forma gran variedad de compuestos como, por ejemplo, los ácidos grasos, esenciales para la vida, y los ésteres que dan sabor a las frutas; además es vector, a través del ciclo carbono-nitrógeno, de parte de la energía producida por el Sol.
WEBGRAFIA :
GRACIAS


https://acristofaro.com/sasha-czack-biografia-hechos-vida-familiar-del-fotografo-y-ex-esposa-de-sylvester-stallone/
ResponderEliminarLa sangre se extrae de una vena, por lo general de la parte interior del codo o del dorso de la mano. El sitio de punción se limpia con un antiséptico y luego se coloca una banda elástica alrededor del antebrazo con el fin de ejercer presión y hacer que las venas se llenen de sangre.