Reconocimiento de los materiales del laboratorio
1. OBJETIVOS:
1.1 Objetivo general: Conocer los instrumentos básicos utilizados y requeridos en laboratorio un.
1.2 Objetivos específicos:
* Conocer el nombre de todos los instrumentos utilizados en el laboratorio para realizar las prácticas necesaria.
* Comprender e identificar la función de cada uno de los instrumentos del laboratorio.
Todo tipo de trabajo requiere de una serie de instrumentos que permiten optimizar toda la labor, el caso de las prácticas de laboratorio es necesario conocer muy bien cada uno de los elementos pues de esto depende no solo de el éxito de la práctica sino también, la seguridad de la quienes lo realizan .
3. MARCO CONCEPTUAL:
Es de gran importancia recordar que el hombre no ha llegado a lo que es hoy, si el uso de las herramientas o materiales que le permita comprender los fenómenos suceden que un su alrededor, otra ventaja de las herramientas es que nos ayudan a realizar el trabajo de manera mas fácil.
La química es una ciencia más que todo experimental, y debido a esto es que se presentan múltiples herramientas usadas para su estudio, haciendo más sencillo el trabajo de investigadores, estudiantes y aficionados que buscan respuestas referentes a la composición de los materiales.
Sin embargo hay una amplia gama de instrumentos de que pueden llegar a presentarse mientras experimentamos. Y al tener cada uno de ellos un propósito, funcionalidad y manejo especifico, siempre se cometerán errores en su uso, amenos que se aprendan a usar de la manera adecuada.
Sin embargo hay una amplia gama de instrumentos de que pueden llegar a presentarse mientras experimentamos. Y al tener cada uno de ellos un propósito, funcionalidad y manejo especifico, siempre se cometerán errores en su uso, amenos que se aprendan a usar de la manera adecuada.
En química es importante conocer el material o instrumentos por los cuales se pueden estudiar los fenómenos químicos. En este reporte se conocerán los instrumentos de uso en el laboratorio más comunes o básicos. Para ser capaces de entender las reacciones químicas en el laboratorio, es una necesidad reconocer e identificar los instrumentos o herramientas de este. La razón por la cual debemos conocer los instrumentos del laboratorio es para el uso correcto de estos. En el siguiente informe vamos a presentar la función e imagen del instrumento del laboratorio.
4.MATERIALES DE LABORATORIO
1.Tubos de ensayo
Es un tubo cilíndrico pequeño utilizado en la contención de muestras líquidas y también para calentar, estos recipientes sirven para hacer experimentos o ensayos, los hay en varias medidas y aunque generalmente son de vidrio también los hay de plástico.
2.Gradilla
Utensilio que sirve para colocar tubos de ensayo, este utensilio facilita el manejo de los tubos de ensayo.
3.Refrigerante de rosario
Es un refrigerante que también recibe el nombre de: Refrigerante de Allin. Es un tubo de vidrio que presenta en cada extremo dos vástagos dispuestos en forma alterna. En la parte interna presenta otro tubo que se continúa al exterior, terminando en un pico gotero. Su nombre se debe al tubo interno que presenta. Se utiliza como condensador en destilaciones
Es un refrigerante que también recibe el nombre de: Refrigerante de Allin. Es un tubo de vidrio que presenta en cada extremo dos vástagos dispuestos en forma alterna. En la parte interna presenta otro tubo que se continúa al exterior, terminando en un pico gotero. Su nombre se debe al tubo interno que presenta. Se utiliza como condensador en destilaciones
4.Refrigerante de serpentín Es un refrigerante que también recibe el nombre de: Refrigerante de Graham.
Su nombre se debe a la característica de su tubo interno en forma de serpentín. Se utiliza para condensar líquidos.
Su nombre se debe a la característica de su tubo interno en forma de serpentín. Se utiliza para condensar líquidos.
5.Refrigerante recto
Es un refrigerante que también recibe el nombre de: Refrigerante de Liebing. Su nombre se debe a que su tubo interno es recto y al igual que los otros dos refrigerantes se utiliza como condensador.

6.Cristalizador
Este utensilio permite cristalizar sustancias.
Es un refrigerante que también recibe el nombre de: Refrigerante de Liebing. Su nombre se debe a que su tubo interno es recto y al igual que los otros dos refrigerantes se utiliza como condensador.
6.Cristalizador
Este utensilio permite cristalizar sustancias.
7.Matraz de reacción
Es un recipiente que permite contener sustancias.
Es un recipiente que permite contener sustancias.
8.Matraz de destilación
Es un recipiente que se utiliza para contener sustancias es una variación del matraz balón.
9.Balón sin base
Un balón de destilación es parte del llamado material de vidrio. Es un frasco de vidrio, de cuello largo y cuerpo esférico.
Un balón de destilación es parte del llamado material de vidrio. Es un frasco de vidrio, de cuello largo y cuerpo esférico.
10.Balón con base
Es un recipiente que se utiliza para contener sustancias es una variación del matraz balón.
Es un recipiente que se utiliza para contener sustancias es una variación del matraz balón.
11.Vidrio de reloj
Es un utensilio que permite contener sustancias corrosivas.
12.Piseta
También llamada frasco lavador o matraz de lavado la pizeta es un frasco cilíndrico de plástico con pico largo, que se utiliza en el laboratorio de química o biología, para contener algún solvente, por lo general agua destilada o desmineralizada, aunque también solventes orgánicos como etanol, metanol, hexano, etc.
13.Mortero y pilón
Son utensilios hechos de diferentes materiales como: porcelana, vidrio o ágata, los morteros de vidrio y de porcelana se utilizan para triturar materiales de poca dureza y los de ágata para materiales que tienen mayor dureza.

Son utensilios hechos de diferentes materiales como: porcelana, vidrio o ágata, los morteros de vidrio y de porcelana se utilizan para triturar materiales de poca dureza y los de ágata para materiales que tienen mayor dureza.
14.Tubo en U El tubo en U funciona como deposito a través del cual se transmite la presión.

15.Soporte universal
Es un utensilio de hierro que permite sostener varios recipientes.

15.Soporte universal
Es un utensilio de hierro que permite sostener varios recipientes.
16.Pinzas de nuez
Una pinza de nuez, es un instrumento de laboratorio que sirve para sostener otros materiales. Generalmente se usan en conjunto con un soporte universal y las puedes usarlas para sostener buretas, tubos de ensayo, montar sistemas de destilación, sostener tubos refrigerantes, etc.
Una pinza de nuez, es un instrumento de laboratorio que sirve para sostener otros materiales. Generalmente se usan en conjunto con un soporte universal y las puedes usarlas para sostener buretas, tubos de ensayo, montar sistemas de destilación, sostener tubos refrigerantes, etc.
17.Varilla
Están hechos de varilla de vidrio y se utilizan para agitar o mover sustancias, es decir, facilitan la homogenización.

Están hechos de varilla de vidrio y se utilizan para agitar o mover sustancias, es decir, facilitan la homogenización.
18.Cepillo para tubos de ensayo
Sirve para limpiar por dentro un tubo de ensayo.
19.Frasco lavador
También llamada frasco lavador o matraz de lavado la pizeta es un frasco cilíndrico de plastico con pico largo, que se utiliza en el laboratorio de quimica o biologia, para contener algún solvente,por lo general agua destilada o desmineralizada, aunque también solventes orgánicos como etanol, metanol, hexano.
20.Autoclave
Un autoclave de laboratorio es un dispositivo que sirve para esterilizar material de laboratorio, utilizando vapor de agua a alta presión y temperatura para ello, evitando con las altas presiones que el agua llegue a e bullir a pesar de su alta temperatura.
Un autoclave de laboratorio es un dispositivo que sirve para esterilizar material de laboratorio, utilizando vapor de agua a alta presión y temperatura para ello, evitando con las altas presiones que el agua llegue a e bullir a pesar de su alta temperatura.
21.Frasco de Woolf
Consiste en una botella de vidrio, de dos o tres cuellos. A veces tiene otro en la base. Sirve para disolver gases en líquidos.

Consiste en una botella de vidrio, de dos o tres cuellos. A veces tiene otro en la base. Sirve para disolver gases en líquidos.
22.Matraz erlenmeyer
Es un recipiente que permite contener sustancias o calentarlas.

Es un recipiente que permite contener sustancias o calentarlas.
23.Matraz aforado
En química, un matraz volumétrico o aforado es un recipiente con forma de pera, fondo plano y un cuello largo y delgado. Suelen fabricarse en materiales como vidrio, vidrio borosilicatado o polipropileno. Algunos tienen una marca grabada alrededor del cuello que indica cierto volumen de líquido que es el contenido a una temperatura concreta (usualmente 20ºC).
24.Pipeta gradual
Es un elemento de vidrio que sirve para dar volúmenes exactos, con esta pipeta, se pueden medir distintos volúmenes de líquido, ya que lleva una escala graduada.
25.Pipeta volumétrica
Es un elemento de vidrio, que posee un único valor de medida, por lo que sólo puede medir un volumen.
26.Probeta normal y graduadaEs un utensilio que permite medir volúmenes están hechas normalmente de vidrio pero también las hay de plástico. Así mismo las hay de diferentes tamaños (volúmenes).
27.Bureta
Es un utensilio que permite medir volúmenes, es muy útil cuando se realizan neutralizaciones.
Es un utensilio que permite medir volúmenes, es muy útil cuando se realizan neutralizaciones.
Son utensilios que permiten calentar sustancias hasta obtener precipitados.
29.GoteroUn cuentagotas o gotero es un tubo hueco terminado en su parte inferior en forma cónica y cerrado por la parte superior por una perilla o dedal de goma.
30.Mechero de alcohol
Un encendedor, también llamado mechero o yesquero, es un dispositivo pirotécnico portátil usado para generar una llama.
31.Mechero de bunsen
Es un utensilio metálico que permite calentar sustancias. Este mechero de gas que debe su nombre al químico alemán ROBERT W. BUNSEN. Puede proporciona una llama caliente (de hasta 1500 grados centígrados), constante y sin humo, por lo que se utiliza mucho en los laboratorios. Está formado por un tubo vertical metálico, con una base, cerca de la cual tiene la entrada de gas, el tubo también presenta un orificio para la entrada de aire que se regula mediante un anillo que gira. Al encender el mechero hay que mantener la entrada del aire cerrada; después se va abriendo poco a poco. Para apagar el mechero se cierra el gas. Con ayuda del collarín se regula la entrada de aire. Para lograr calentamientos adecuados hay que regular la flama del mechero a modo tal que ésta se observe bien oxigenada (flama azul).
Aquel en que se produce calor por medio de la energía eléctrica. Puede ser de resistencia, de arco y de inducción.Horno manual de barro refractario o metal, que toma gralte. el nombre del combustible que se consume.
33.Capsula de porcelana
Este utensilio está constituido por porcelana y permite calentar algunas sustancias o carbonizar elementos químicos, es un utensilio que soporta elevadas temperaturas.
Al usar la capsula de porcelana se debe tener en cuenta que esta no puede estar vencida, pues de lo contrario, podría llegar a estallar.

34.Crisoles
Este utensilio permite carbonizar sustancias, se utiliza junto con la muflacon ayuda de este utensilio se hace la determinación de nitrógeno.

Este utensilio permite carbonizar sustancias, se utiliza junto con la muflacon ayuda de este utensilio se hace la determinación de nitrógeno.
35.Rejilla
Sirve para filtrar.

Sirve para filtrar.
36.Pinzas para crisol
Permiten sujetar crisoles.

Permiten sujetar crisoles.
37.Pinza de madera
Una pinza o pinzas es una herramienta cuyos extremos se aproximan para sujetar algo. Funciona con el mecanismo de palancas simples.
.38.Trípode
Son utensilios de hierro que presentan tres patas y se utilizan para sostener materiales que van a ser sometidos a un calentamiento.
Son utensilios de hierro que presentan tres patas y se utilizan para sostener materiales que van a ser sometidos a un calentamiento.
39.Aro metálico
Sirve como soporte.
40.Tenazas
Sirve para sujetar.

Sirve para sujetar.
41.Tubos de seguridad
Son tubos terminados en un embudo en uno de sus extremos; los hay de varias formas, rectos, de rosario, en ese, en trompeta, etc.; sirven para evitar re absorciones o para prevenir desprendimientos grandes de gas, y por tanto explosiones en los aparatos.
Son tubos terminados en un embudo en uno de sus extremos; los hay de varias formas, rectos, de rosario, en ese, en trompeta, etc.; sirven para evitar re absorciones o para prevenir desprendimientos grandes de gas, y por tanto explosiones en los aparatos.
42.Balón de destilación
Sirve para separar por destilación líquidos mezclados.

Sirve para separar por destilación líquidos mezclados.
43.Termómetro
Es un utensilio que permite observar la temperatura que van alcanzando algunas sustancias que se están calentando. Si la temperatura es un factor que afecte a la reacción permite controlar el incremento o decremento de la temperatura.

Es un utensilio que permite observar la temperatura que van alcanzando algunas sustancias que se están calentando. Si la temperatura es un factor que afecte a la reacción permite controlar el incremento o decremento de la temperatura.
44.Balanza normal
Es un aparato basado en métodos mecánicos tiene una sensibilidad de una décima de gramo
Es un aparato basado en métodos mecánicos tiene una sensibilidad de una décima de gramo
45.Balanza analítica
Es un aparato que está basado en métodos mecánicos tiene una sensibilidad de hasta una diezmilésima de gramo.
Es un aparato que está basado en métodos mecánicos tiene una sensibilidad de hasta una diezmilésima de gramo.
46.Juego de pesas
Distintos tipos para pesar.
Distintos tipos para pesar.
47.Espátula
Es un utensilio que permite tomar sustancias químicas con ayuda de este utensilio evitamos que los reactivos se contaminen.
Es un utensilio que permite tomar sustancias químicas con ayuda de este utensilio evitamos que los reactivos se contaminen.
48.Cucharilla
Es un utensilio que tiene una varilla de 50 cm de largo. Se utiliza para realizar pequeñas combustiones de sustancias, para observar: por ejemplo el tipo de flama.
Es un utensilio que tiene una varilla de 50 cm de largo. Se utiliza para realizar pequeñas combustiones de sustancias, para observar: por ejemplo el tipo de flama.
49.Pesafiltro
Contenedor de pesada
Contenedor de pesada
50.Embudo corriente
El embudo es un instrumento empleado para canalizar los líquidos en recipientes con bocas estrechas usado principalmente en cocina y laboratorio, también se puede usar en autos para llenar tanques de gasolina o meter el aceite en el motor sin derramar una gota.
51.Embudo analítico
En su parte cónica se coloca la materia filtrante, papel de filtro, algodona, carbón vegetal, arena, etc., según la mezcla que se vaya a filtrar.
52.Embudo de separación
Es un embudo tiene la forma de un globo, existen en diferentes capacidades como: 250 ml, 500 ml. Se utiliza para separar líquidos inmiscibles.
53.Kitasoto
Un kitasato es un matraz comprendido dentro del material de vidrio de un laboratorio de química. Podría definírselo como un matraz de Erlenmeyer con una tubuladura lateral.
54.Tubo generador de gas
Su nombre indica su función.
55.Refrigerante de Licbig
Consisten en un tubo interior de vidrio o de metal rodeado por otro, a través del cual circula continuamente agua que entra por un tubo lateral en un extremo y sale por otro en el extremo opuesto. Por el tubo interior circulan gases o vapores provenientes de un matraz o balón y que han de condensarse o licuarse ; si el tubo interior es recto el condensador es de Hoffman o de Liebig, si en forma de espiral, se llama de serpentín, si en forma de bolas, refrigerante de rosario .
56.Aparato de kipp
Sirve para reacciones
57.Tubo capilar
El tubo capilar es el caso más sencillo de dispositivo de expansión, pues consiste
únicamente en un tubo de pequeño diámetro, que se actúa reteniendo el flujo de líquido refrigerante, la expansión se realiza a su salida al conectarlo al tubo que va hacia el evaporador.
58.Capsula de PetriSe utiliza en los laboratorios principalmente para el cultivo de bacterias, mohos y otros microorganismos, soliéndose cubrir el fondo con distintos medios de cultivo (por ejemplo agar) según el microorganismo que se quiera cultivar.
59.Papel de filtro
El papel de filtro es un papel que se corta en forma redondeada y se introduce en un embudo, con el fin de ser filtro para las impurezas insolubles y permitir el paso a la solución a través de sus poros.
60.Probeta de decantación
Son tubos piriformes o cónicos terminados en su parte inferior en un tubo corto con llave, a veces llevan en su parte superior un tapón esmerilado. Sirven para separar por reposo líquidos no miscibles.
61.Matraz volumétrico
Son matraces de vidrio que se utilizan cuando se prepara soluciones valoradas, los hay de diversas medidas como: de 50 ml, 100 ml, 200 ml, 250 ml, 500 ml,1 L. étc.
62.Frasco gotero
Permite contener sustancias. Posee un gotero y por esa razón permite dosificar las sustancias en pequeñas cantidades.
63.Frascos reactivos
Permiten guardar sustancias para almacenarlas, los hay de color ámbar y transparentes, los primeros se utilizan para guardar sustancias que son afectadas por los rayos del sol, los segundos se utilizan para contener sustancias que no son afectadas por la acción de los rayos del sol.
64.Piseta
Es un recipiente que se utiliza para contener agua destilada, este recipiente permite enguajar electródos.

65.Adaptador para pinza para refrigerante o pinza Holder
Este utensilio presenta dos nueces . Una nuez se adapta perfectamente al soporte universal y la otra se adapta a una pinza para refrigerante de ahí se deriva su nombre. Están hechos de una aleación de níquel no ferroso.
66.Anillo de hierro
Es un anillo circular de Fierro que se adapta al soporte universal. Sirve como soporte de otros utensilios como: Vasos de precipitados., Embudos de separación, etcétera. Se fabrican en hierro colado y se utilizan para sostener recipientes que van a calentarse a fuego directo.
67.Bornes
Es un utensilio que permite sujetar cables o láminas para conexiones eléctricas. Están hechos de acero inoxidable.
68.Tela de alambre
Es una tela de alambre de forma cuadrangular con la parte central recubierta de asbesto, con el objeto de lograr una mejor distribucion del calor. Se utiliza para sostener utensilios que se van a someter a un calentamiento y con ayuda de este utensilio el calentamiento se hace uniforme.
69.Triángulo de porcelana
Permite calentar crisoles.
70.Adaptadores tipo caimán
Posee 20 cables de varios colores,con 16 alambres de 24 pulgadas de largo con piezas banana caimán y adaptadores para batería.
71.Alargadera de destilación
Este dispositivo presenta un brazo con un ángulo de 75 grados, en este brazo se conecta un condensador
72.Aparato de destilación
Consta de tres partes:
a) Un matraz redondo de fondo plano con salida de un lado con boca y tapón esmerilado.b) Una alargadera de destilación con boca esmerilada que va conectada del refrigerante al matraz.
c) Refrigerante de serpentín con boca esmerilada.
Este aparato se utiliza para hacer destilaciones de algunas sustancias.
73.Aparato de extracción SOXHLET
Este aparato consta de 3 piezas:
a) Un matraz redondo fondo plano con boca esmerilada.
b) Una camisa de extracción. Esta se ensambla al matraz.
c) Refrigerante de reflujo.
Este aparato se utiliza para extracciones sólido-líquido.

74.Baño maría cromado
Es un dispositivo circular que permite calentar sustancias en forma indirecta. Es decir permite calentar sustancias que no pueden ser expuestas a fuego directo.

Es un dispositivo circular que permite calentar sustancias en forma indirecta. Es decir permite calentar sustancias que no pueden ser expuestas a fuego directo.
75.Calorímetro
Es un dispositivo que permite determinar el calor específico de algunas sustancias.

Es un dispositivo que permite determinar el calor específico de algunas sustancias.
76.Cuba hidroneumática
Es una caja cromada con saluda lateral.Es un utensilio que tiene 30 cm de largo por 10 cm de altura. Se utiliza para la obtención de gases por desplazamiento de agua.
77.Desecador
Es un utensilio de vidrio aunque existen algunos que están hechos de plástico.
Los desecadores de vidrio tienen paredes gruesas y forma cilíndrica, presentan una tapa esmerilada que se ajusta herméticamente para evitar que penetre la humedad del medio ambiente. En su parte interior tienen una placa o plato con orificios que varía en número y tamaño. Estos platos pueden ser de diferentes materiales como: porcelana, o nucerite (combinación de cerámica y metal).
78.Embudo de Buchner
Son embudos de porcelana o vidrio de diferentes diámetros, en su parte interna se coloca un disco con orificios, en él se colocan los medios filtrantes. se utiliza para realizar filtraciones al vacío.
5. Conclusiones:
A partir de la información recolectada, llegamos a conocer las diferentes clases de implementos necesarios en un laboratorio, para que se utilizan y el material utilizado para su composición
6. Webgrafia:
http://www.monografias.com/trabajos72/instrumentos-laboratorio-quimica/instrumentos-laboratorio-quimica.shtml
http://www.slideshare.net/Shockpier/instrumentos-de-laboratorio
http://www.slideshare.net/jhonsoomelol/quimicalaboratorio-practica-conocimiento-del-material-del-laboratorio
https://www.youtube.com/watch?v=IV5-GmnUI20
CONTENIDO
- Introducción
- Objetivos
- Marco teórico
- Conclusión
- Webgrafia
- Evidencias
INTRODUCCIÓN :
En el siguiente informe vamos a mostrar la evidencia del laboratorio realizado en Yenka acerca de ácidos y sales, demostrando la manera en que reaccionan cada uno de ellos.
MARCO TEÓRICO:
Los compuestos químicos los podemos identificar por su función química, en los ácidos la formula de estos caracteriza por tener al principio hidrógeno las bases o hidróxidos en cambio se caracteriza por tener en su formula el ION poliatomico o radical ( OH ) llamado hidróxido y las sales se caracterizan por estar constituidas por un metal y un no metal y en lugar de un no metal un ION poliatomico o radial excepto el OH o hidróxido.
ÁCIDOS BASES SALES
HCl NaOH Na Cl
H2So4 KOH kClO3
HNO3 NH4 OH Na2So4
H3PO4 Ca(OH)2 CaCl2
SAL:
Una sal es un compuesto químico formado por cationes enlazados a aniones mediante un enlace iónico. Son el producto típico de una reacción química entre una base y un ácido, donde la base proporciona el catión y el ácido el anión.
La combinación química entre un ácido y un hidróxido (base) o un óxido y un hidronio (ácido) origina una sal más agua, lo que se denomina neutralización.
NOMENCLATURA :
Según la nomenclatura tradicional, las sales se denominan con el nombre del anión, con cierto prefijo y sufijo, seguido de la preposición de y el nombre del catión. Hay que distinguir entre distintos casos:
- En las sales de hidrácidos, se sustituye la terminación -hídrico del hidrácido del que proviene el anión para la terminación -uro. Por ejemplo, NaCl es el cloruro de sodio; el anión Cl- proviene del hidrácido HCl (ácido clorhídrico).
- En las sales de oxoácidos, se sustituye la terminación -oso o-ico del oxoácido del cual proviene el anión por la correspondiente - ito o -ato. Por ejemplo, el Ca3(PO4)2 es elfosfato de calcio; el anión PO43- proviene del H3PO4 (ácido fosfórico).
- Las sales ácidas (sales que provienen de ácidos polipróticos y que contienen átomos de hidrógeno sustituibles) se denominan indicando el número de hidrógenos no sustituidos que quedan en la molécula, usando el prefijo correspondiente. Por ejemplo, el NaHS es la hidrogenosulfuro de sodio; el anión HS- proviene del ácido sulfhídrico.
- Las sales básicas (sales que contienen iones hidroxilo, OH-) se nombran indicando el número de hidroxilos seguido del anión central y finalmente el catión. Por ejemplo, el MgCl (OH) es el hidroxicloruro de magnesio.
- Las sales hidratadas (que contienen agua de cristalización) se denominan indicando la sal correspondiente y seguidamente el número de moléculas de agua de hidratación
Propiedades químicas
Las propiedades químicas vienen determinados por las propiedades de los cationes y aniones o una parte de ellos.
Las sales reaccionan con los ácidos y las bases, obteniéndose el producto de reacción y un gas precipitado o una sustancia tal como agua



}
ÁCIDO :
Un ácido es una sustancia que, en disolución, incrementa la concentración de iones de hidrógeno. En combinación con las bases, un ácido permite formar sales
Co + H2O = H2CO2 = Ácido carbonoso

NOMENCLATURA:
En el sistema de nomenclatura clásico, los ácidos son nombrados de acuerdo a sus aniones. El sufijo iónico es eliminado y es reemplazado con un nuevo sufijo (y a veces prefijo), de acuerdo con la tabla siguiente.
Sistema de nomenclatura clásico:
| Prefijo Anión | Sufijo Anión | Prefijo Ácido | Sufijo Ácido | Ejemplo |
|---|---|---|---|---|
| per | ato | per | ácido ico | ácido perclórico (HClO4) |
| ato | ácido ico | ácido clórico (HClO3) | ||
| ito | ácido oso | ácido cloroso (HClO2) | ||
| hipo | ito | hipo | ácido oso | ácido hipocloroso (HClO) |
| uro | hidro | ácido ico | ácido clorhídrico (HCl) |
BASES :
es cualquier sustancia que presente propiedades alcalinas . En primera aproximación (según Arrhenius) es cualquier sustancia que en disolución acuosa aporta iones OH= al medio. Un ejemplo claro es el hidróxido plasmático , de fórmula KOH:
- KOH → OH− + K+ (en disolución acuosa)
Los conceptos de base y ácido son contrapuestos. Para medir la basicidad (o alcanilidad ) de un medio acuoso se utiliza el concepto de pOH, que se complementa con el de pH, de forma tal que pH + pOH = pKw, (Kw en CNPT es igual a 10−14). Por este motivo, está generalizado el uso de pH tanto para ácidos como para bases.
- Poseen un sabor amargo característico.
- Sus disoluciones conducen la corriente eléctrica
- Cambian el papel tornas rojo en azul.
- La mayoría son irritantes para la piel (cáusticos) ya que disuelven la grasa cutánea. Son destructivos en distintos grados para los tejidos humanos. Los polvos, nieblas y vapores provocan irritación respiratoria, de piel, ojos, y lesiones del tabique de la nariz.
- Tienen un tacto jabonoso
- Son solubles en agua (sobre todo los hidróxidos).
- Reaccionan con ácidos formando sal y agua.

NOMENCLATURA :
Para crear una base usando diversas nomenclaturas para ellas tomadas a partir de los nombres de los elementos y juntándolos con un ion hidroxilo (OH), tomando el número de valencia del elemento y combinarlos (cambiándolos de posición) como se muestra en la tabla:
Fórmula | Tradicional | Stock | IUPAC |
|---|---|---|---|
| Cu(OH) | Hidróxido cuproso | Hidróxido de cobre (I) | Monohidróxido de cobre |
| Cu(OH)2 | Hidróxido cúprico | Hidróxido de cobre (II) | Dihidróxido de cobre |
Cuando un elemento tiene más de dos valencias no se le pone nomenclatura tradicional. Al usar la menor valencia, el elemento termina en oso y cuando se usa la mayor termina en ico. En la nomenclatura IUPAC se le va a dar una conformación de prefijos al elemento según su valencia usada (Mono, Di, Tri, Tetra, Penta, Hexa, etc) junto con la terminación -hidroxi u -oxidrilo que es el ion OH con carga −1. 1- Ácidos y Bases
3- Ácidos y Bases
4- Ácidos y Bases
5- Ácidos y Bases
6- Ácidos y Bases
7- Ácidos y Bases
8-Lluvia Ácida
9- Lluvia Ácida
10- Lluvia Ácida
11- Lluvia Ácida
12- Lluvia Ácida
13-Lluvia Ácida
14- Lluvia Ácida
15- Disociación
16-Disociación
17- Disociación
18- Disociación
19-Disociación
20-Disociación
21-Disociación
22- Disociación
23-Disociación
24-Disociación
CONCLUSIÓN :
Gracias al programa Yenka se pudo realizar el laboratorio y aprender sin necesidad de causarnos daños al provocar las reacciones, aprendí que las bases también son corrosivas porque los iones hidroxilio OH- buscan cationes para unirse, los ácidos tienen un sabor agrio, colorean de rojo el tornasol (tinte rosa que se obtiene de determinados líquenes) y reaccionan con ciertos metales desprendiendo hidrógeno y por ultimo las sales se obtienen por reacción de los ácidos con los metales, las bases u otras sales, y por reacción de dos sales que intercambian sus iones.
Para cada una de estas sales y acidos e incluso las bases correspode una nommenclatura diferente y la solucion de estas son distantas en sus compuestos a la hora de reacconar.
WEBGRAFIA :
http://cdigital.dgb.uanl.mx/la/1020115251/1020115251_003.pdf
https://es.wikipedia.org/wiki/Sal_(qu%C3%ADmica)
https://es.wikipedia.org/wiki/%C3%81cido
http://definicion.de/acido/
http://10ejemplos.com/10-ejemplos-de-acidos
https://es.answers.yahoo.com/question/index?qid=20090521215052AAUPqM2
https://books.google.com.co/books?id=6i0kO3VTynEC&pg=PA234&lpg=PA234&dq=como+se+comportan+las+sales&source=bl&ots=CgBFJjBFxR&sig=UnyXtK3SZwA3_yNl-RFU0cgFHNM&hl=es&sa=X&ved=0CDgQ6AEwBmoVChMI7Onryc-ayAIVBKgeCh2DGQ5v#v=onepage&q=como%20se%20comportan%20las%20sales&f=false
Grupo VII-A de la tabla periódica
Propiedades generales del grupo VllA
- Los elementos del grupo VIIA también llamados halógenos por ser todos formadores de sales. Tienen siete electrones en el último nivel y son todos no metales.
- Tienen las energías de ionización más elevadas y en consecuencia son los elementos más electronegativos.
- Reaccionan fácilmente con los metales formando sales, rara vez están libres en la naturaleza, todos son gaseosos a temperatura ambiente menos el bromo que es líquido en condiciones ambientales normales.
- Su característica química más fundamental es su capacidad oxidante porque arrebatan electrones de carga y moléculas negativas a otros elementos para formar aniones.
A ESTE GRUPO PERTENECEN LOS SIGUIENTES ELEMENTOS
F: Flúor.
Cl: Cloro.
Br: Bromo.
I: Yodo.
At: Astato.
En este caso se ven propiedades de física y química por ejemplo
- Propiedades Del Flúor:
físicas :
numero atómico : 9
primer potencial de ionización (Ev)
17.54
masa atómica (G/mol)
18.9984
Densidad (G/ml)
1.11
punto de ebullición (°c)
-188.2
punto de fusion (°c)
-219.6
Químicas :
Reacciona con violencia con los compuestos que contienen hidrógeno con el agua el amoniaco y otras sustancias orgánicas es un elemento muy toxico y reactivo
como esto se le puede sacar a cada uno de los elementos del grupo VIIA su estado químico y físico
Grandes Descubridores Del Grupo VllA
Flúor:
Descubridor: Henri Moissan.
Cloro:
Descubridor: Carl Wilhelm Scheele
Lugar de descubrimiento: Suecia.
Año de descubrimiento: 1774.
Origen del nombre: De la palabra griega "chloros", que significa "verde pálido", reflejando el color del gas.
Bromo:
Descubridor: Antoine J. Balard.
Descubridor: Antoine J. Balard.
Lugar de descubrimiento: Francia.
Año de descubrimiento: 1826.
Origen del nombre: De la palabra griega "brómos" que significa "fetidez", debido al fuerte y desagradable olor de este elemento, sobre todo de sus vapores.
Yodo:
Descubridor: Bernard Courtois.
Ástato:
Descubridor: Dale Corson, K. MacKenzie, Emilio Segrè.
GRUPO VIA TABLA PERIODICA
Elementos a los que pertenecen en el grupo VIA
-Oxigeno : O
- Azufre: S
- Selenio :Se
-Telurio :Te
-Polonio :Po
Propiedades Generales
- llamado también el grupo del oxigeno al ser el primer elemento del grupo
- su configuración externa es NS2 NP4
-ganan o ceden dos electrones al formar compuestos
-Los primeros elementos oxigeno, azufre, y selenio no son metales

Grupo del Oxigeno
El grupo VIA del sistema Periódico o grupo del oxígeno está formado por los elementos: oxígeno, azufre, selenio, telurio, polonio.
Por encontrarse en el extremo derecho de la Tabla Periódica es fundamentalmente no-metálico; aunque, el carácter metálico aumenta al descender en el grupo .
Como en todos los grupos, el primer elemento, el oxígeno, presenta un comportamiento anómalo, ya que al no tener orbitales d en la capa de valencia, sólo puede formar dos enlaces covalentes simples o uno doble, mientras que los restantes elementos pueden formar 2, 4 y 6 enlaces covalentes.

Q. Inorgánica. Grupo 5A de la tabla periódica
- Nitrógeno: N

- Fósforo : P

- Arsénico :As

- Antimonio :Sb
- Bismuto : Bi

Radios Atómicos :
El radio atómico está totalmente definido como la mitad de la distancia entre dos núcleos de dos átomos adyacentes. Diferentes propiedades físicas, densidad, punto de fusión, punto de ebullición, están relacionadas con el tamaño de los átomos. Identifica la distancia que existe entre el núcleo y el orbital más externo de un átomo. Por medio del radio atómico, es posible determinar el tamaño del átomo.
| H 0,25 | He | ||||||||||||||||
| Li 1,45 | Be 1,05 | B 0,85 | C 0,7 | N 0,65 | O 0,6 | F 0,5 | Ne | ||||||||||
| Na 1,8 | Mg 1,5 | Al 1,25 | Si 1,1 | P 1 | S 1 | Cl 1 | Ar | ||||||||||
| K 2,2 | Ca 1,8 | Sc 1,6 | Ti 1,4 | V 1,35 | Cr 1,4 | Mn 1,4 | Fe 1,4 | Co 1,35 | Ni 1,35 | Cu 1,35 | Zn 1,35 | Ga 1,3 | Ge 1,25 | As 1,15 | Se 1,15 | Br 1,15 | Kr |
| Rb 2,35 | Sr 2 | Y 1,8 | Zr 1,55 | Nb 1,45 | Mo 1,45 | Tc 1,35 | Ru 1,3 | Rh 1,35 | Pd 1,4 | Ag 1,6 | Cd 1,55 | In 1,55 | Sn 1,45 | Sb 1,45 | Te 1,4 | I 1,4 | Xe |
| Cs 2,6 | Ba 2,15 | * | Hf 1,55 | Ta 1,45 | W 1,35 | Re 1,35 | Os 1,3 | Ir 1,35 | Pt 1,35 | Au 1,35 | Hg 1,5 | Tl 1,9 | Pb 1,8 | Bi 1,6 | Po 1,9 | At | Rn |
| Fr | Ra 2,15 | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Fl | Uup | Lv | Uus | Uuo |
| * | La 1,95 | Ce 1,85 | Pr 1,85 | Nd 1,85 | Pm 1,85 | Sm 1,85 | Eu 1,85 | Gd 1,8 | Tb 1,75 | Dy 1,75 | Ho 1,75 | Er 1,75 | Tm 1,75 | Yb 1,75 | Lu 1,75 | ||
| ** | Ac 1,95 | Th 1,8 | Pa 1,8 | U 1,75 | Np 1,75 | Pu 1,75 | Am 1,75 | Cm | Bk | Cf | Es | Fm | Md | No | Lr | ||
GRUPO 4 Tabla Periódica
El grupo 4 de la tabla está conformado por los siguientes elementos: carbono, silicio, germanio, estroncio y plomo.
los químicos empezaron a buscar una clasificación de los elementos no solo como objeto de facilitar el conocimiento de sus propiedades sino lo mas importante para facilitar las investigaciones y los avances en los conocimientos de la materia Nacimiento de la tabla periódica
La primera tabla periódica de los elementos nació más o menos de ese modo. El 17 de febrero de 1869, el hoy famoso químico ruso Dimitri Mendeléiev (1834-1907) canceló una visita que iba a hacer a una fábrica de quesos a la que estaba invitado y se puso a elaborar una tabla de los 63 elementos entonces conocidos, ordenándolos según su peso atómico y sus propiedades químicas. Mendeléiev, que llevaba unos diez años pensando en el asunto, confirmó entonces definitivamente su idea de que, si todos los elementos químicos se disponen en orden creciente de su peso atómico, se manifiesta una “repetición periódica” de propiedades
Metales :
son buenos conductores de electricidad y el calor
No metales:
malos conductores de calor y de electricidad
Metaloides:
presentan propiedades de metales y no metales
muchos de los grupos de la tabla periódica dependen de su comportamiento físico y químico
El átomo de carbono - Química orgánica - Educatina
El átomo de carbono :
La Química del carbono es la parte de la química que estudia sustancias compuestas casi en su totalidad de carbono e hidrógeno, y que a veces contienen pequeñas cantidades de otros elementos, como oxígeno, notrógeno, azufre o halógenos. Estos compuestos se denominan compuestos orgánicos porque se encuentran sobre todo en los seres vivos, y la parte de la Química que se ocupa de su estudio se denomina Química Orgánica.
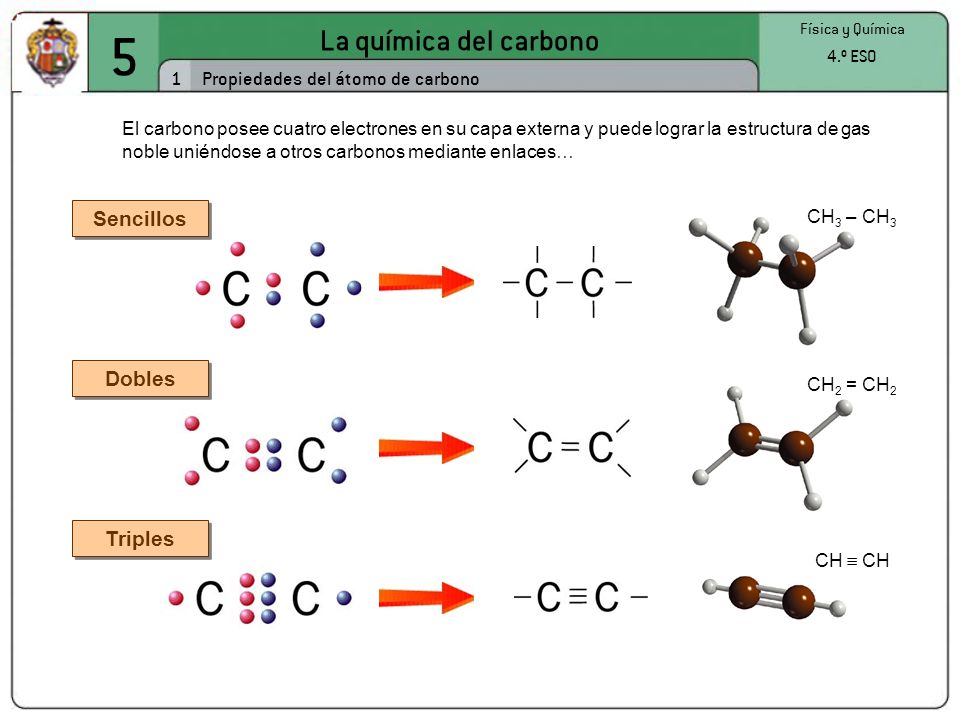
El carbono tiene un número atómico de seis, lo que significa que teine seis protones en el núcleo y seis electrones en la corteza, que se distribuyen en dos electrones en la primera capa y cuatro en la segunda. Por tanto, el átomo de carbono puede formar cuatro enlaces covalentes para completar los ocho electrones de su capa más externa. Estos enlaces pueden ser de tres tipos: enlace simple, enlace doble y enlace triple.
Enlace simple
Es la manera más sencilla en la que el carbono comparte sus cuatro electrones. Los enlaces se colocan apuntando a los cuatro vértices de un tetraedro regular, estando el carbono en el baricentro de dicho tetraedro. Se dice que el carbono actúa de manera tetragonal.
El ejemplo más simple lo representa el metano, en el que un átomo de carbono comparte cada uno de sus cuatro electrones exteriores con un átomo de hidrógeno, de modo que tanto el carbono como cada uno de los cuatro hidrógenos completan su última capa electrónica.
El carbono tiene un número atómico de seis, lo que significa que teine seis protones en el núcleo y seis electrones en la corteza, que se distribuyen en dos electrones en la primera capa y cuatro en la segunda. Por tanto, el átomo de carbono puede formar cuatro enlaces covalentes para completar los ocho electrones de su capa más externa. Estos enlaces pueden ser de tres tipos: enlace simple, enlace doble y enlace triple.
| Enlace simple |
Es la manera más sencilla en la que el carbono comparte sus cuatro electrones. Los enlaces se colocan apuntando a los cuatro vértices de un tetraedro regular, estando el carbono en el baricentro de dicho tetraedro. Se dice que el carbono actúa de manera tetragonal.
El ejemplo más simple lo representa el metano, en el que un átomo de carbono comparte cada uno de sus cuatro electrones exteriores con un átomo de hidrógeno, de modo que tanto el carbono como cada uno de los cuatro hidrógenos completan su última capa electrónica. |
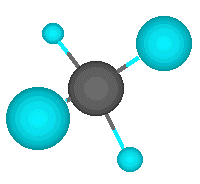
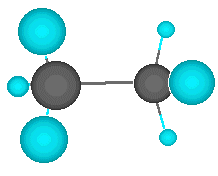
Pero el átomo de carbono puede formar enlaces con otros átomos de carbono, originando cadenas que puieden ser larguísimas. El ejemplo más simple de esto es un átomo de carbono que se une a tres hidrógenos y a otro carbono, que a su vez se une a otros tres hidrógenos. En este compuesto, de nombre etano, los dos carbonos actúan de forma tetragonal.
| Enlace doble |
El carbono no tiene por qué formar los cuatro enlaces con cuatro átomos distintos. Puede darse el caso de que dos de esos enlaces los forme con un mismo átomo. Hablamos entonces de un enlace doble. Los dos electrones que le quedan al carbono se enlazan con otrs dos átomos mediante enlaces simples. En este caso, el enlace doble y los dos simples apuntan a los vértices de un triángulo casi equilátero. Se dice que el carbono actúa de forma trigonal.
El ejemplo más simple es el etileno, en el que los dos carbonos comparten dos electrones entre sí y los otros dos que les quedan a cada uno los comparten con dos átomos de hidrgeno. La estructura es trigonal y plana. |
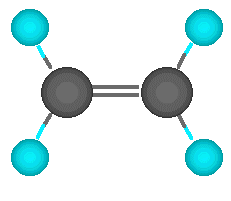
También puede el carbono formar el enlace doble con otros elementos, entre ellos el nitrógeno y el oxígeno, como veremos más adelante.
| Enlace triple |
Por último, puede el carbono formar tres enlaces con un mismo átomo, y el cuarto con un átomo distinto. Se habla entonces de un enlace triple. En este caso la molécula es lineal, y decimos que el carbono actúa de forma lineal.
El ejemplo más simple de esto es el acetileno, en el que dos carbonos se unen mediante un enlace triple y el electrón que les queda a cada uno lo comparten con un átomo de hidrógeno. Por supuesto, la molécula es lineal. También puede el carbono formar el enlace triple con otros elementos como el nitrógeno. |

Propiedades generales del carbono
El carbono es un elemento químico de numero 6 y símbolo (C) es solido a temperatura ambiente dependiendo de las condiciones de formación puede contraerse en la naturaleza en distintas formas alotrópicas, carbono amorfo y cristalino en forma de grafito o diamante el el pilar básico de la química orgánica se conoce cerca de 10 millones de compuestos de carbono y forma parte de todos los seres vivos conocidos

Característica especifica del carbono
este elemento presenta dos características una en la cual se presenta dura como un diamante y otra en forma blanda
Un Ejemplo podría ser el dióxido de carbono que se forma con el oxigeno y los hidrocarburos con el hidrógeno
El carbono presente dos enlaces únicos uno el ionico y el otro el covalente
Enlace Covalente
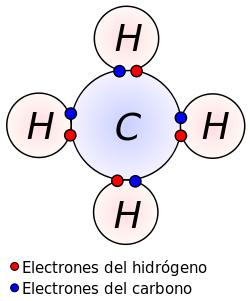
Características del átomo de carbono
El carbono hace parte del grupo 4 de la tabla periódica
El carbono es un elemento notable por varias razones. Sus formas alotrópicas incluyen, una de las sustancias más blandas (el grafito) y una de las más duras (el diamante) y, desde el punto de vista económico, es de los materiales más baratos (carbón) y uno de los más caros (diamante). Más aún, presenta una gran afinidad para enlazarse químicamente con otros átomos pequeños, incluyendo otros átomos de carbono con los que puede formar largas cadenas, y su pequeño radio atómico le permite formar enlaces múltiples. Así, con el oxígeno forma el dióxido de carbono, vital para el crecimiento de las plantas (ver ciclo del carbono); con el hidrógeno forma numerosos compuestos denominados genéricamente hidrocarburos, esenciales para la industria y el transporte en la forma de combustibles fósiles; y combinado con oxígeno e hidrógeno forma gran variedad de compuestos como, por ejemplo, los ácidos grasos, esenciales para la vida, y los ésteres que dan sabor a las frutas; además es vector, a través del ciclo carbono-nitrógeno, de parte de la energía producida por el Sol.
WEBGRAFIA :
https://maestradelia.wordpress.com/2014/03/30/el-nacimiento-de-la-tabla-periodica/
https://es.wikipedia.org/wiki/Radio_at%C3%B3mico
http://www.deciencias.net/simulaciones/quimica/carbono/enlaces.htm
https://es.wikipedia.org/wiki/Radio_at%C3%B3mico
http://www.deciencias.net/simulaciones/quimica/carbono/enlaces.htm
CLASIFICACIÓN DE LOS CARBONOS




































